全面解析AKK菌作用肠道免疫调节的机制!显著改善炎症性肠病IBD、结肠炎、肠易激综合症!
这篇综述全面解析AKK菌作用免疫的机制
AKK菌的功效强大源于它跨出肠道微生物圈
定植更深的黏膜屏障来显著作用代谢和免疫
巨噬细胞/树突状细胞/T 细胞/潘氏细胞调节免疫
代谢物和活性成分供养肠道共生有益菌 免疫力强
蛋白P9和 Amuc_1100、Amuc_1409多效用抗炎
产丁酸盐促进调节性T细胞(Treg)的外周活化
增加结肠中Treg细胞 抑制促炎免疫细胞的活性
“下一代NGP——明星益生菌AKK”

Science多篇报道实锤免疫疗法重在肠道菌群
Akk菌能极大地增强免疫治疗的效果
AKK菌“自产自足”最大限度发挥“益生”特性
代谢产物给生产粘液的“厂家”上皮细胞供能
助力免疫屏障合成产出免疫细胞、免疫分子
抗炎抑炎、助长有益菌、维持肠道菌群平衡
显著改善炎症性肠病、IBD和肠易激综合征

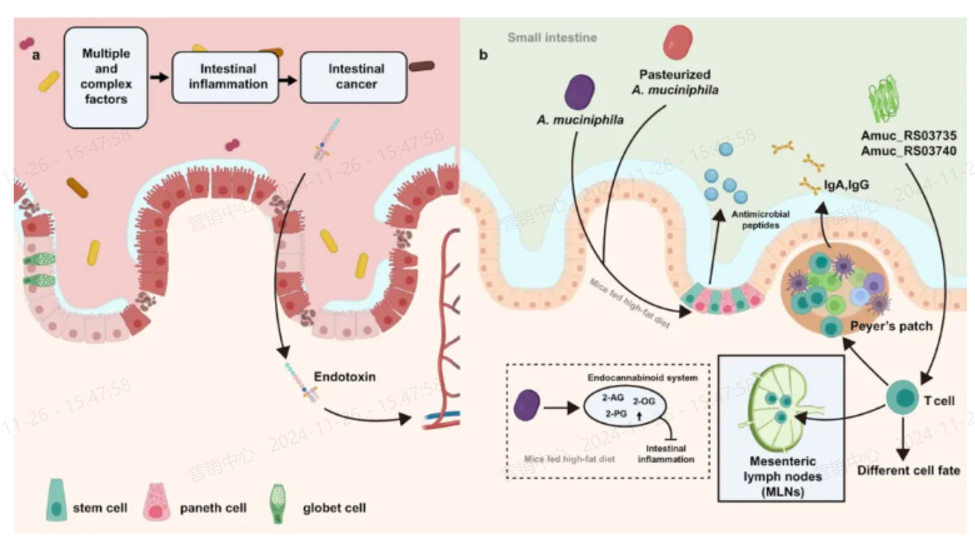
AKK菌的丰度与不同的肠道疾病有关,炎症性肠病(IBD),包括克罗恩病(CD)和溃疡性结肠炎(UC),是结直肠癌(CRC)发展的已知风险因素;
2022年nature子刊发表最新报道,本综述中我们汇集了最新研究,全面讨论了A. muciniphila在人类胃肠道(GIT)中的特征、分布和定植和总结,证明了AKK菌作为下一代益生菌NGP在调节宿主肠道免疫力方面发挥着重要作用。
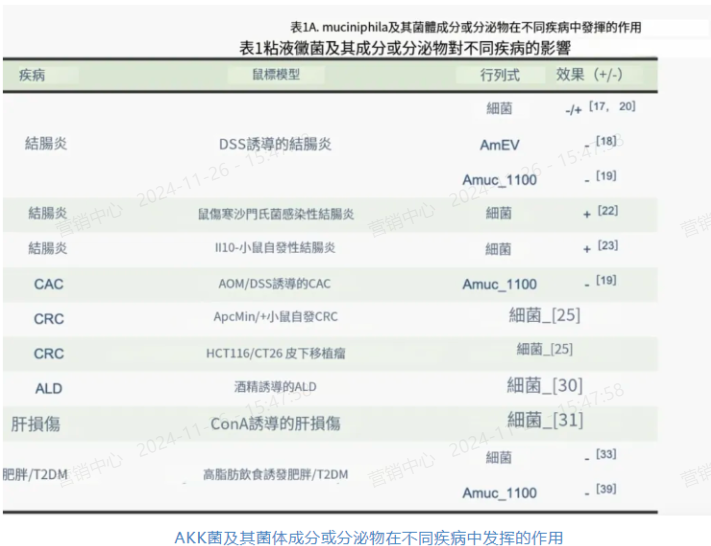
健康个体的嗜粘液杆菌数量远高于IBD患者,在健康人群中AKK菌的相对丰度可达3%-5%,但在非炎症UC(0.03%)、炎症UC(0.02%)、非炎症CD(0.62%)和炎症CD(0.20%)患者中发现急剧下降。
AKK菌肠道免疫的机制
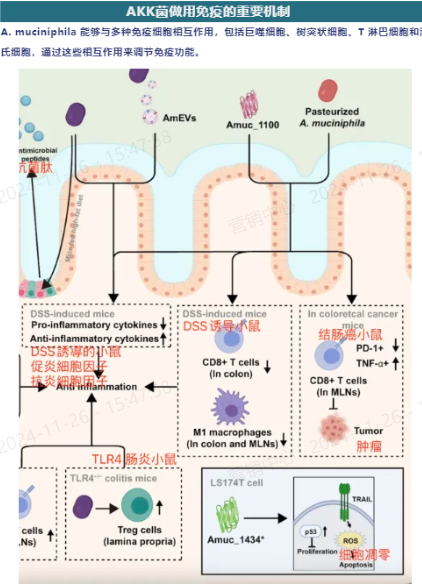
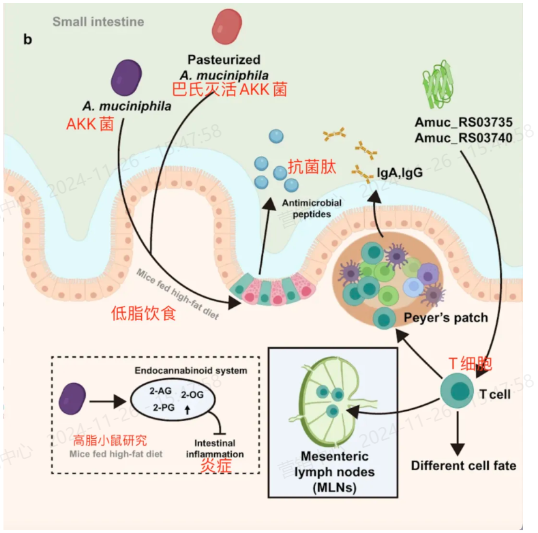
促进调节性T细胞(Tregs)的分化和增殖:在口服活A. muciniphila的小鼠中,观察到外周调节性T细胞(pTregs)的分化,以及结肠中胸腺衍生的Tregs(tTregs)的增殖,这可能是由A. muciniphila的表位2 C.1重新编程的。
与TLR4受体的相互作用:A. muciniphila与TLR4受体正相关,并通过增加RORγt+ Treg细胞的比例增强免疫反应,这表明A. muciniphila可能通过与宿主的TLR4受体相互作用来调节免疫反应。
减少细胞毒性T淋巴细胞(CTL)的浸润:巴氏杀菌的A. muciniphila和其成分Amuc_1100能够减少CD8+ CTL的结肠浸润,这些CTL通过介导细胞因子的产生来加重结肠炎。
抑制促炎巨噬细胞的增殖:巴氏杀菌的A. muciniphila还能抑制肠膜淋巴结(MLN)中促炎CD16/32+巨噬细胞的增殖,并降低DSS诱导的结肠炎小鼠的促炎细胞因子的mRNA水平。
促进肿瘤细胞的细胞凋亡:在结直肠癌(CRC)的小鼠模型中,巴氏杀菌的A. muciniphila和Amuc_1100增加了MLN中CTL的激活和肿瘤坏死因子-α(TNF-α)+ CTL的比例,以促进肿瘤细胞的细胞凋亡。
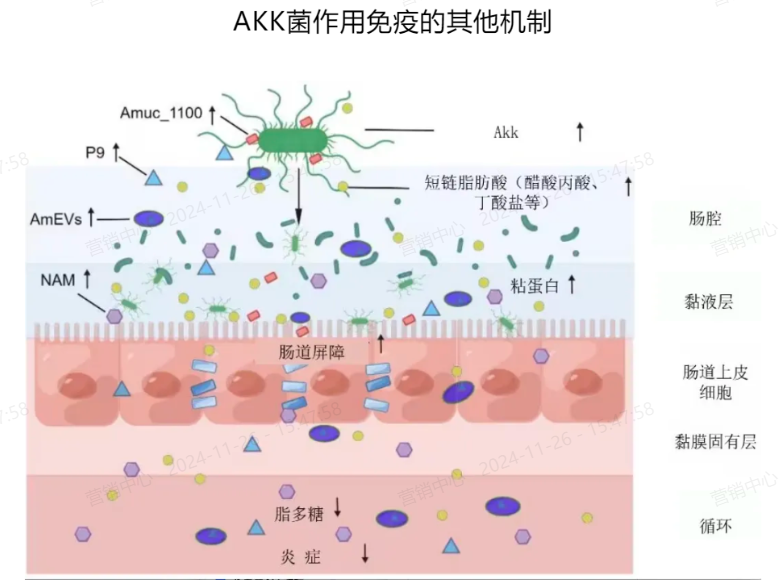
增强肠道屏障功能 改善肠易激综合症
A. muciniphila 通过分解黏蛋白并刺激杯状细胞合成黏蛋白,达到动态平衡,从而维持黏液层的稳定。它还能通过上调紧密连接蛋白的表达,影响肠道屏障功能,减少脂多糖(LPS)降低内毒素,改善机体炎症。
▌膜蛋白P9、Amuc_1100、Amuc_1409多效用抗炎
AKK菌联合多作用抗炎机制狂飙!AKK菌的外膜蛋白P9和 Amuc_1100多效用抗炎,如Amuc_1100激活Toll样受体2(TLR2)及其下游NF-κB途径,以调节新陈代谢和免疫力。
▌代谢产物短链脂肪酸和活性成分
细胞外囊泡和代谢物如短链脂肪酸(SCFA),SCFAs为肠上皮细胞提供能量,促进肠道黏膜的修复,维持肠道屏障功能,免受病原体侵害;同时提升鸟氨酸脂质、γ-氨基丁酸、钴胺素和肌苷,帮助调节宿主的免疫反应。
▌AKK菌免疫调节的药理学机制“磷脂”
AKK菌通过细胞膜上的磷脂分子a15:0-i15:0 PE(约占AKK菌脂质膜的50%)诱导免疫细胞分泌特定细胞因子,如TNFα和IL-6,这种脂质分子还能重置树突状细胞的活化阈值,调控后续免疫刺激。
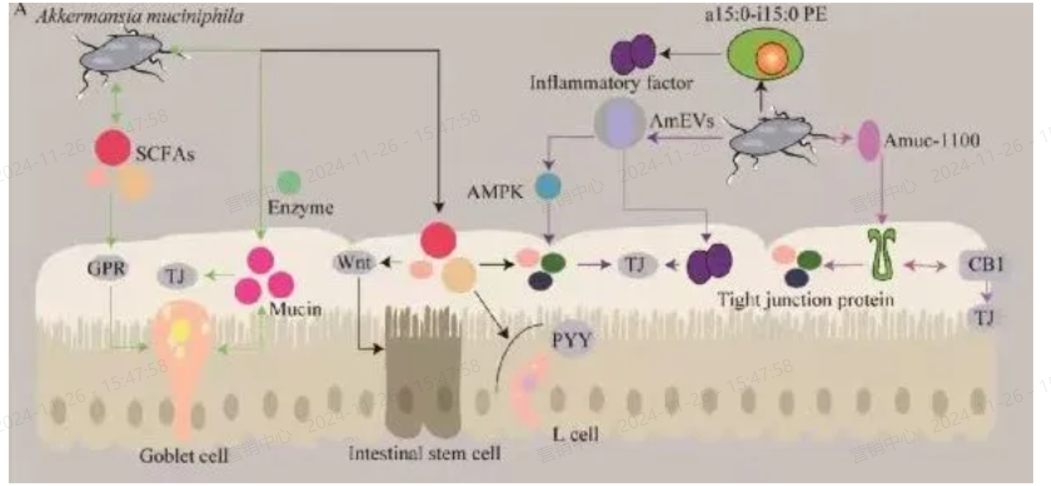
综上所述,增加肠道中A. muciniphila 的丰度是增强免疫功能的一种安全有效的方法。
通过对肠道免疫功能的改善,多效用改善炎症性肠病、肠易激综合征,调节代谢类病症如糖尿病、肥胖症;同时AKK菌可产丁酸菌对神经炎症类疾病如阿兹海默症、自闭症、癫痫、渐冻症都有良好改善。
期待在不久的将来AKK菌能成为具有治疗意义的有益菌!


