嗜黏蛋白阿克曼氏菌:一种有前景的抗炎症和代谢紊乱的益生菌
文章名称:Akkermansia muciniphila: A promising probiotic against inflammation and metabolic disorders.
期刊名称:Virulence
影响因子:5.5
发表时间:2024.9
原文链接:https://doi.org/10.1080/21505594.2024.2375555
前言
肠道微生物群由多种多样且充满活力的微生物种群组成,包括细菌、真菌、病毒和原生生物。肠道微生物群在人类健康中的作用至关重要;因此,肠道微生物群丰度和组成的改变被认为与多种疾病有关。大量研究表明,某些微生物与肥胖、炎症性疾病、2 型糖尿病 (T2DM)、癌症和神经退行性疾病等疾病之间存在很强的关联。因此,人们越来越关注使用不同方法治疗肠道微生物群的代谢疾病,包括益生菌、益生元和粪便微生物群移植 。益生菌是有益微生物,在调节肠道微生物群和增强宿主免疫力方面起着至关重要的作用。传统的益生菌通常来自发酵食品,以乳酸为主。然而,传统益生菌存在质量问题,例如污染和活菌数量不足。在观察到的肠道菌群中,嗜粘蛋白阿克曼菌是一种很有前途的益生菌,近年来已广泛用于多种疾病的不同模型。
嗜粘蛋白阿克曼菌是肠道中一种丰富的共生细菌,可有效利用粘蛋白作为其碳、氮和能量的唯一来源,从而为上皮细胞提供能量。自发现以来,嗜粘蛋白阿克曼菌逐渐受到关注,现在被认为是一种很有前途的下一代益生菌。有人提出,嗜粘蛋白阿克曼菌水平的变化与各种疾病有关,例如肥胖、炎症性疾病、糖尿病和寄生虫病 。此外,一些研究人员报道了嗜粘蛋白 (Amuc_1100) 和嗜粘蛋白阿克曼菌衍生的细胞外囊泡 (AmEVs) 的外膜蛋白在调节和改善肠道功能方面发挥作用。
尽管有许多关于嗜粘蛋白阿克曼菌的综述,但对其对疾病机制的调控总结仍然不够全面和深入。在这篇综述中,作者全面了解了 A. muciniphila 在改善宿主健康方面的作用,并讨论了 A. muciniphila 在未来研究中的观点。作者还详细阐述了嗜粘蛋白阿克曼菌与宿主免疫之间的相关性,这在其他综述文章中讨论较少。此外,作者总结了嗜粘蛋白阿克曼菌与病原体感染之间的关系,这在其他综述文章中很少报道。此外,还讨论了嗜粘蛋白阿克曼菌对各种疾病有益的主要机制。最后,作者总结了近 3 年报道的有关嗜粘蛋白阿克曼菌与疾病之间关系的文献。通过回顾大量文献,作者总结了嗜粘蛋白阿克曼菌在改善宿主健康方面的重要进展,并讨论了嗜粘蛋白阿克曼菌在未来研究中的观点。本文对嗜粘蛋白阿克曼菌作为益生菌在不同疾病中的作用提供了见解,从而为促进临床治疗应用提供了蓝图。
嗜粘蛋白阿克曼菌的主要特性
A. muciniphila 是一种椭圆形、不运动的细菌,于 2004 年首次分离和描述。大多数研究都集中在嗜粘蛋白 A. mucT (ATCC BAA-835) 类型菌株上。嗜粘蛋白阿克曼菌属于疣微菌门,在可培养的胃肠道样品中代表疣微菌群。此外,嗜粘蛋白阿克曼菌菌最初被归类为严格的革兰氏阴性厌氧菌,广泛分布于人类和动物肠道中,盲肠中数量最多。然而,一些研究报道,嗜粘蛋白阿克曼菌可以耐受少量氧气,超过 90% 的嗜粘蛋白阿克曼菌在暴露在空气中一小时后可以存活。嗜粘蛋白芽孢杆菌 MucT 和嗜甘氨酸阿克曼菌 Pyt 的全基因组T测序后发现,嗜粘蛋白曲霉基因编码的多种酶可以降解寡糖链,如糖苷酶、硫酸酯酶和唾液酸酶。这些酶释放聚糖以促进粘蛋白降解细菌的生长并影响肠道微生物群的丰度。
A. muciniphila 嗜粘蛋白阿克曼菌存在于母乳和消化道的不同部位,如小肠、大肠、胰腺和胆道系统 。在健康的成年人中,粪便中的细菌数量从 109到 1010CFU/g,嗜粘蛋白阿克曼菌的量约为 106到 108CFU/g,占肠道细菌总数的 1% 至 4%。有趣的是,嗜毛霉菌在早期生命中就在人类肠道中被发现,其丰度在一年内达到成人水平 。A. muciniphila 主要存在于肠道的粘液层,对增强肠道屏障、产生粘液和维持粘液层厚度有显着影响。有人提出,嗜粘蛋白 A. muciniphila 降解粘蛋白产生单糖、低聚糖和链脂肪酸,它们可以作为宿主以及其他细菌的能量来源。最近的一项系统文献综述得出结论,嗜粘蛋白在含有粘蛋白的环境中生长效率最高,粘蛋白由胃肠道组织中的杯状细胞持续产生。因此,嗜粘蛋白曲霉的定植不仅仅依赖于饮食,还具有明显的生存优势。此外,几项研究发现,嗜粘蛋白阿克曼菌可以在人类和接受抗生素治疗的小鼠的消化系统中存活,表明其对抗生素具有耐药性。
嗜粘蛋白阿克曼菌与宿主免疫之间的联系
宿主及其肠道微生物群共同进化成一种强烈的共生关系,其中肠道微生物群在维持宿主稳态方面起着至关重要的作用 。肠道微生物群对宿主先天性和适应性免疫系统关键组成部分的训练和发展具有至关重要的影响。除了在调节感染和共生生物体传播中的作用外,微生物组-免疫相互作用还涉及多种疾病 。尽管肠道微生物群与人类健康问题之间的关系越来越明朗,特别是在对免疫系统的影响方面,但在了解控制和调整免疫平衡的确切分子因素以及它们的运作机制方面仍然存在明显的不足 。
肠道 IgG 抗体反应的发生被认为仅限于粘膜屏障破坏的情况或对侵入肠道屏障的肠道病原体和特定病原体的反应 。已经表明,当肠道微生物群存在时,T 细胞会显着激活,利用抗 IgG2b 和 IgG3 非依赖性途径,这主要依赖于 toll 样受体 (TLR) 的存在 。Ansaldo 等人报道,嗜粘蛋白阿克曼菌触发小鼠 IgG1 抗体的产生并引发对抗原特异性的 T 细胞反应。此外,在生物环境中,特异于嗜粘蛋白 A 的 T 细胞反应仅限于 T 滤泡辅助细胞,不会促使其他 T 辅助细胞反应或向固有层移动。Kuczma 等人报道,来自嗜粘蛋白阿克曼菌的微生物抗原可诱导无反应并促进幼稚CD4CD44 Foxp3 − T (Tn) 细胞向 Treg 谱系的转化。
研究结果表明,肠上皮细胞 (IEC) 中的 NF-κB 可以被嗜粘蛋白阿克曼菌激活,而无需 TLR 和 NOD 受体参与。然而,Toll 样受体 2 (TLR2) 及其下游 NF-κB 通路的激活是由 Amuc_1100 引发的。通过调节 TLR2 激活的 γδT17 细胞和巨噬细胞极化,嗜粘蛋白阿克曼菌有效预防小鼠非酒精性脂肪性肝炎。据报道,嗜毛蛋白 A. 的苏氨酰-tRNA 合成酶 (AmTARS) 诱导 M2 巨噬细胞的极化,并通过其独特的进化获得区域管理 IL-10 的产生,从而能够与 TLR2 发生特异性相互作用。通过这种相互作用激活 MAPK 和 PI3K/AKT 信号通路导致 cAMP 反应元件结合蛋白 (CREB) 的收敛,从而促进 IL-10 的高效产生并抑制中枢炎症介质 NF-kB。嗜粘蛋白芽孢杆菌执行免疫功能,毫无疑问,宿主和嗜粘蛋白嗜粘蛋白芽孢杆菌之间的相互作用还涉及其他机制,这些机制仍未得到探索。
嗜粘蛋白阿克曼菌与疾病的相关性
关于嗜粘蛋白阿克曼菌,人们越来越关注将其用作益生元治疗多种疾病。已发现嗜粘蛋白阿克曼菌丰度的变化与代谢紊乱有关,例如 T2DM、肥胖、非酒精性脂肪肝 (NAFLD) 和心血管疾病 。在这些疾病中,嗜粘蛋白阿克曼菌与肥胖之间的联系已得到广泛研究。此外,除了与代谢紊乱相关的嗜粘蛋白阿克曼菌水平的改变外,嗜粘蛋白阿克曼菌的积极影响也已证明与免疫相关疾病有关,例如溃疡性结肠炎 (UC) 和克罗恩病 (CD) 。除了这些健康问题外,还研究了嗜粘蛋白阿克曼菌与神经系统疾病以及癌症之间的相关性。有趣的是,近年来,大量研究表明,寄生虫感染后嗜粘蛋白阿克曼菌的水平发生了变化 ,提出了一种治疗寄生虫病的有前途的方法。
肠粘液层的产生和分泌由杯状细胞进行,然后覆盖在 IEC 上。嗜粘蛋白阿克曼菌存在于粘液层中,可以降解肠道粘液以产生关键的代谢物短链脂肪酸 (SCFA)。肠道疾病与嗜粘蛋白阿克曼菌之间的关系取决于健康的粘液层和粘膜免疫反应。有人提出,嗜粘蛋白阿克曼菌可以通过重建粘液层的厚度和在小鼠中表达抗菌肽来改善代谢紊乱。A. muciniphila 增加粘液层厚度的机制尚不清楚。可能的机制如下:一方面,嗜粘蛋白 A. muciniphila 通过降解粘蛋白产生大量 SCFAs,这些 SCFA 是参与粘蛋白合成和分泌的上皮细胞的宝贵能量来源;另一方面,粘蛋白的降解可以刺激杯状细胞产生更多的新粘蛋白,粘蛋白还可以促进嗜粘蛋白阿克曼菌的发育;产生正反馈回路,良性循环可以不断更新粘液层,从而对肠上皮细胞起到保护作用。
代谢紊乱中肠道平衡的紊乱与肠道免疫系统的功能密切相关 。肠道是防止有害物质进入体内的物理屏障。研究发现,嗜粘蛋白阿克曼菌可以通过恢复小鼠粘液层的厚度和增加抗菌肽 Reg3g 的肠道表达来增强肠道屏障功能,这两者都在肥胖和代谢紊乱期间发生改变。此外,研究表明,来自 A. muciniphila 的细胞外囊泡再现了细菌的一些积极作用,并且还可以通过控制小鼠的紧密连接来降低肠道通透性。除了与代谢紊乱相关的肠道通透性改变外,研究还表明,嗜粘蛋白阿克曼菌在肠道炎症期间对肠道屏障功能有积极影响。大量研究表明,嗜粘蛋白阿克曼菌通过增强肠道屏障的完整性并通过各种机制(如增厚粘液层、改善上皮连接和改变粘液成分)调节免疫系统来保护宿主免受疾病侵害。已经观察到嗜粘蛋白阿克曼菌的几种有益作用,以及使用巴氏杀菌嗜粘蛋白阿克曼菌时的疗效显着提高。因此,需要更多的研究来探索嗜粘蛋白阿克曼菌和巴氏杀菌嗜粘蛋白阿克曼菌对不同疾病的有益作用。
嗜粘蛋白阿克曼菌在肠道炎症性疾病中的潜在功能
炎症性肠病 (IBD) 的发病机制尚不完全清楚,但它是一种慢性复发性免疫介导的疾病。代谢和胃肠道疾病通常是由肠道稳态和肠道屏障完整性的破坏引起的。肠道菌群强烈影响肠道屏障功能和肠道稳态。葡聚糖硫酸钠 (DSS) 诱导的结肠炎模型已广泛用于研究肠道菌群与 IBD 之间的相互作用。也有一些研究使用三硝基苯磺酸 (TNBS) 诱导的结肠炎模型来评估嗜粘蛋白阿克曼菌对结肠炎的有益影响。尽管嗜粘蛋白阿克曼菌的益生菌特性在代谢性疾病中已得到广泛认可,但其在肠道炎症性疾病中的治疗潜力仍然存在争议 。嗜粘蛋白阿克曼菌在动物和临床前模型中越来越多地被用作治疗 IBD 的益生菌 。几项研究表明,嗜粘蛋白阿克曼菌及其化合物在不同模型中对肠道炎症性疾病发挥保护作用。A. muciniphila 被认为能够再生粘液层并保持肠道完整性。研究表明,与健康受试者相比,溃疡性结肠炎患者的嗜粘蛋白阿克曼菌水平显着降低 。Bian 等人报道了嗜粘蛋白阿克曼菌在 DSS 诱导的结肠炎小鼠模型中的保护作用,并解释了其潜在机制。已经提出了几种可能的机制,包括 (1) 结肠粘膜屏障损伤得到改善 (2) 炎症反应的调节,(3) 肠道微生物群的重建 (4) 代谢功能的调节 。根据 Qu 等人的说法,溃疡性结肠炎 (UC) 患者粪便中嗜粘蛋白阿克曼菌的丰度低于健康个体。补充嗜粘蛋白阿克曼菌可显著改善 DSS 诱导的急性结肠炎症状。补充嗜粘蛋白阿克曼菌导致炎症细胞浸润减少,杯状细胞数量增加,以及 MUC2 和 MUC3 的表达增加。此外,UC 个体结肠组织中的 NLRP3 显著上调,补充嗜粘蛋白阿克曼菌 NLRP3 上调,表明嗜粘蛋白阿克曼菌对急性结肠炎的积极作用可能取决于 NLRP3 的激活。Wang 等人发现,嗜粘蛋白阿克曼菌或源自嗜粘蛋白阿克曼菌的膜蛋白 (Amuc_1100) 可以通过调节 CD8 T 细胞来改善 DSS 诱导的小鼠结肠炎 。近端结肠的组织学损伤改善,促炎细胞因子(包括 IFN-γ 、 IL-1β 和 TNF-α 显著下调。此外,补充嗜粘蛋白阿克曼菌或Amuc_1100剂可延迟肿瘤形成,肿瘤数量和大小减少。此外,一些成分和分泌物也与肠道炎症的发生有关 。来自 A. muciniphila 的 AmEVs 在 DSS 诱导的 IBD 粪便中的组成显着降低。口服 AmEVs 可缓解 DSS 诱导的 IBD 表型,包括体重减轻、结肠长度减少和结肠壁炎性细胞浸润。
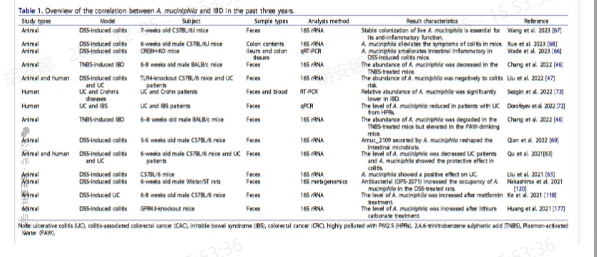
然而,一些研究表明,嗜粘蛋白阿克曼菌可能导致肠道炎症的发展 。结果发现,DSS 诱导的 IBD 小鼠嗜粘蛋白阿克曼菌水平升高,其相对水平与结肠组织病理学损伤和炎症的严重程度呈正相关。除了 DSS 诱导的结肠炎模型外,嗜粘蛋白阿克曼菌还促进了其他小鼠模型中肠道炎症的进展。Ganesh 等人报道,在感染鼠伤寒沙门氏菌的小鼠中,口服嗜粘蛋白阿克曼菌会加重结肠炎的症状 。Seregin 等人发现,口服 A. muciniphila 会增加 IL10−/− 小鼠结肠炎的严重程度。Baxter 等人进行的另一项研究报告称,患有结直肠癌 (CRC) 的小鼠接受 CRC 患者的粪便微生物群表现出嗜粘蛋白阿克曼菌的存在与肿瘤负荷升高之间的直接关系 。尽管这些研究表明,嗜粘蛋白阿克曼菌可能是一种机会性病原体并导致结肠炎的发展,但其致病作用的原因和机制仍不清楚。然而,大多数研究表明,嗜粘蛋白阿克曼菌对肠道疾病有益。最后,作者总结了近 3 年嗜粘蛋白阿克曼菌与 IBD 相关性的研究,如下所示表1。
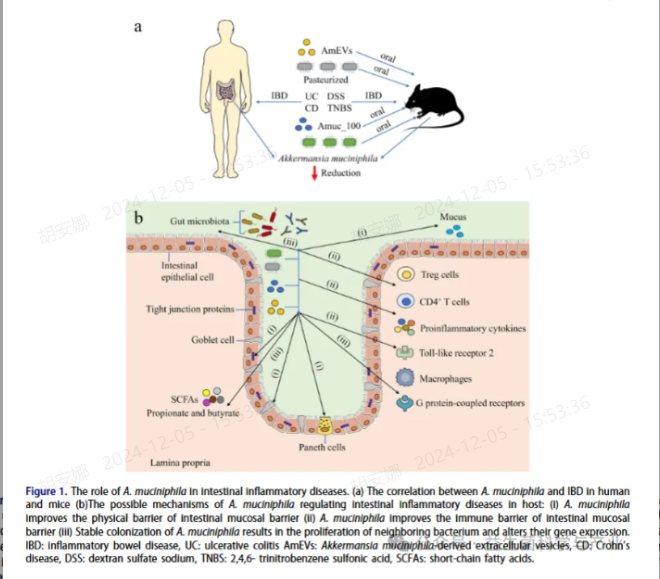
目前,嗜粘蛋白阿克曼菌对肠道炎症性疾病的积极机制大致可以从以下三个方面来解释(图1):(1) 增强肠粘膜屏障的物理屏障;物理屏障由上皮细胞组成,这些细胞通过紧密连接连接并由粘液层保护;嗜粘蛋白曲霉可以维持肠粘膜屏障的完整性,可以提高紧密连接蛋白的产生,降低肠道通透性;补充嗜粘蛋白阿克曼菌可以增加杯状细胞的数量和粘蛋白的分泌,从而使粘液层的厚度正常化 ;此外,嗜粘蛋白阿克曼菌可以有效提高潘氏细胞的数量,将抗菌肽的分泌恢复到正常水平,从而在肠粘膜中发挥保护作用 。(2) 增强肠粘膜屏障的免疫屏障;A. muciniphila 可促进初始 CD4 T 细胞分化为外周 Treg 细胞,并下调促炎细胞因子的表达; 嗜粘蛋白阿克曼菌通过刺激 TLR2 增强 AMPK 信号通路的激活,同时抑制 NF-κB 信号通路,维持肠粘膜免疫功能的平衡;此外,巴氏消毒的嗜粘蛋白阿克曼菌或 Amuc_1100 显示出减少浸润巨噬细胞和细胞毒性 T 淋巴细胞的能力。(3) 嗜粘蛋白阿克曼菌的稳定定植导致邻近细菌的增殖并改变它们的基因表达; 嗜粘蛋白阿克曼菌可以特异性降解粘蛋白和低聚糖以产生代谢物 SCFA,例如丙酸盐和丁酸盐 ;SCFA 具有增强 Treg 细胞分化和改变肠道微生物群组成的能力;丁酸盐被认为可以通过抑制组蛋白脱乙酰酶和激活 G 蛋白偶联受体 (GPR) 来缓解肠道疾病,以增强保护性免疫并改善肠道屏障 ;此外,丁酸盐还可以通过上调紧密连接蛋白和肠粘膜上皮粘液的表达来增强肠粘膜的防御功能 。因此,嗜粘蛋白阿克曼菌作为肠道炎症性疾病的益生菌,通过调节炎症因子维持肠道菌群的平衡,在不同层面保护肠道粘膜屏障结构和功能的完整性,以减少肠道炎症性疾病引起的肠道损伤。
结论
总之,已经证明 A. muciniphila 在促进宿主健康和维持肠道屏障的完整性方面发挥着积极作用。嗜粘蛋白阿克曼菌水平的变化可被视为疾病发展的指标。在这篇综述中,作者总结了各种研究的结果,这些研究侧重于嗜粘蛋白阿克曼菌水平的改变及其对不同疾病的影响,例如 IBD、肥胖、T2DM 和寄生虫病。此外,源自嗜粘蛋白阿克曼菌的代谢物和酶,如 Amuc_1100、AmEV 和 SCFA,在治疗肥胖、IBD 和 T2DM 方面显示出有前途的潜力。对 A.muciniphila 的干预研究主要限于动物实验;因此,进一步的研究应侧重于其在治疗或预防疾病中的安全性和有效性。更重要的是,嗜粘蛋白菌在不同疾病中的功能和作用机制仍然知之甚少,其在临床疾病中的应用还需要进一步研究。


